Хімія.
26.05.20.
група 5 кравців
Урок №32.

26.05.20.
група 5 кравців
Урок №32.
Тема. Лабораторна робота
Окиснення глюкози купрум (ІІ)
гідроксидом.
Мета: повторити хімічні властивості глюкози.
Вміти складати рівняння
реакцій.
Теоретичні відомості
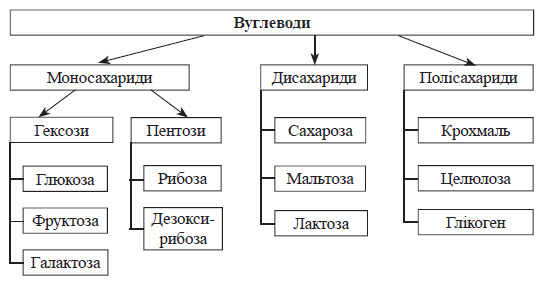
Вуглеводи
– це складні органічні речовини, що є полігідроксиальдегідами або
полігідроксикетонами або утворюють ці речовини в результаті гідролізу.

Реакції за участю гідроксильних груп.
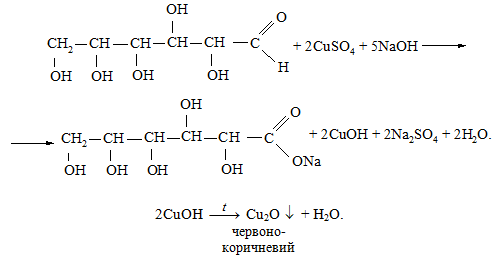
Із купрум(II) гідроксидом без
нагрівання глюкоза реагує як багатоатомний спирт і дає характерне синє
забарвлення.
*Перегляньте нижче поданий малюнок та виконайте віртуальну лабораторну роботу. Напишіть хід роботи у зошит. Заповніть пропущені строки. Зробіть висновки.
Хід роботи
Дослід 1.
Властивості глюкози: а) У пробірку до 3-4 крапель розчину купруму сульфату долийте 2-3 мл розчину натрію гідроксиду. До добутого
купруму гідроксиду долийте такий самий
об’єм глюкози.і суміш збовтайте. Як
змінилось забарвлення розчину? Про що це свідчить?
Напишіть спостереження та рівняння реакції:
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) Пробірку з добутим розчином нагрійте. Опишіть свої
спостереження. Про наявність якої функціональної групи свідчить цей дослід?
Скласти рівняння реакції окиснення глюкози гідроксидом купруму:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновок:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________


Коментарі
Дописати коментар