18.12.2023.
97 трактористів. Хімія. Урок №24(85)
Тема. Загальна характеристика неметалів, їхні фізичні властивості.
Законспектуйте тему відповідно поміченого темним кольором матеріалу
На закріплення випишіть у робочий зошит хімічні знаки усіх неметалів
1. Поширення неметалічних елементів у природі
Неметали у природі
З 118 відомих на даний момент хімічних елементів 96 є металічними і лише 22 хімічні елементи належать до неметалічних.
Неметалічні хімічні елементи широко поширені у земній корі.
Оксиген і Силіцій складають близько 76 % (практично три чверті) від маси земної кори (O2 — 49,4 %, Si — 25,8 %).
Ферум Fe — 4,7 %;
Кальцій Ca — 3,4 %;
Натрій Na — 2,6 %;
Калій K — 2,4 %;
Магній Mg — 1,9 %;
Гідроген H — 0,9 %;
Титан Ti — 0,9 %;
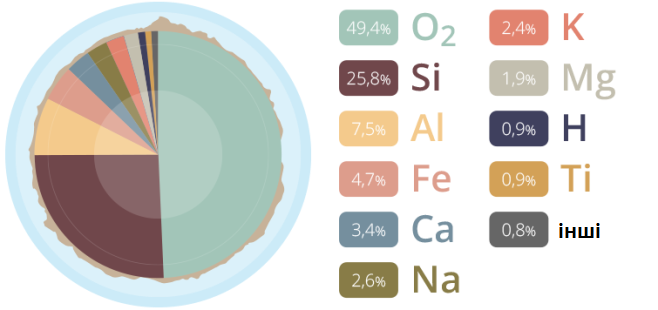
Склад земної кори
Такі хімічні елементи, як Карбон C , Гідроген H , Оксиген O , Нітроген N , Фосфор P , і Сульфур S складають 98,5 % від маси рослин і \ (97,6\) % від маси тіла людини.
На частку неметалічних хімічних елементів припадає велика частина маси живих організмів
До складу земної атмосфери входять як прості, так і складні речовини, утворені неметалічними елементами.
В об'ємних долях на азот N2 припадає 78 %, на кисень O2 — 21 %, а інертні гази становлять0,96 % від об'єму повітря. До складу земної атмосфери також постійно входить карбон(IV ) оксид (вуглекислий газ) CO2 , частка якого (за різними оцінками) становить близько 0,04 % від складу чистого повітря.
Треба мати на увазі, що у повітрі постійно міститься водяна пара H2O та інші сполуки неметалічних елементів, частка яких не є постійною.

Неметалічні хімічні елементи складають більшу частину речовин, що входять до складу повітря
Головний хімічний елемент Всесвіту — це Гідроген. З нього утворені Сонце та інші зорі, газові хмари, тощо. І на нашій планеті з кожних
2. Загальна характеристика неметалічних елементів
Положення неметалічних елементів у Періодичній системі, особливості будови і властивостей їх атомів
У Періодичній системі неметалічні хімічні елементи займають правий верхній кут і містяться тільки у головних (А ) групах.

В електронній оболонці атомів неметалів на зовнішньому енергетичному рівні, як правило, міститься від 4 до 8 електронів. Виняток становлять лише Гідроген H , у якого в електронній оболонці атому взагалі тільки один електрон, Гелій He з двома електронами і Бор B , у якого на зовнішньому енергетичному рівні є три електрони.
Радіуси атомів неметалів є меншими, ніж у металів того ж періоду, тому в силу близькості позитивно зарядженого ядра атому, неметали добре утримують свої валентні електрони (електрони зовнішнього енергетичного рівня).
Характер зміни радіусів атомів хімічних елементів у періодах і в групах. Радіуси атомів неметалічних елементів є значно меншими, ніж радіуси атомів металічних елементів, що містяться у тому самому періоді.
Головна відмінна властивість неметалів — це їх висока електронегативність, тобто здатність у хімічних сполуках притягувати електрони.
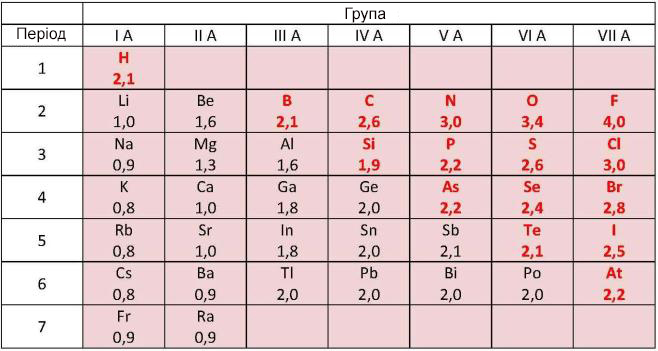
Величини відносних електронегативностей (ВЕН) деяких хімічних елементів (по Л. Полінгу). ВЕН неметалічних хімічних елементів (виділені червоним кольором) перевершує відповідну величину металічних хімічних елементів
Атоми неметалів здатні як приймати, так і віддавати електрони, отже хімічні речовини, що містять такі атоми, у ході перетворень можуть бути як окисниками, так і відновниками.
4. Фізичні властивості неметалів
Властивості неметалічних простих речовин відрізняються великою різноманітністю. Власне кажучи, їх об'єднує лише те, що вони, як правило, не мають тих фізичних властивостей, які є типовими для металів, тобто не володіють характерним металічним блиском, ковкістю, пластичністю, високою тепло- і електропровідністю.
Агрегатний стан
Неметали при нормальних умовах можуть бути газоподібними, рідкими і твердими речовинами.
Газоподібними неметаллами є гелій He , неон Ne , аргон Ar , криптон Kr , ксенон Xe і радон Rn . Їх називають інертними або благородними газами. Кожна «молекула» інертного газу складається лише з одного атому.
Такі хімічні елементи, як Гідроген H , Оксиген O , Нітроген N , Хлор Cl , Флуор F утворюють газоподібні речовини, що складаються з двохатомних молекул, відповідно — H2 , O2 , N2 , Cl2 , F2 .
З неметалічних простих речовин при звичайних умовах рідиною є тільки бром, молекули якого є двоатомними Br2 .
Інші неметалічні хімічні елементи при нормальних умовах є у твердому агрегатному стані. Наприклад, хімічний елемент Карбон утворює такі тверді речовини, як алмаз і графіт. Твердими є кристалічна сірка S8 , фосфор червоний і фосфор білий P4 , кристалічний йод I2 .
Колір і блиск
Тільки деякі неметали на відміну від металів мають блиск. Наприклад, кристалічний йод, кремній і графіт не схожі на інші неметали — вони мають блиск, що трохи нагадує блиск металів.
Якщо для переважної більшості металів характерний сріблясто-сірий або сріблясто-білий колір, то забарвлення неметалів дуже різноманітне. Білий колір має білий фосфор, червоний — червоний фосфор, жовтий — сірка і флуор, червоно-бурий — рідкий бром, жовто-зелений — хлор, фіолетовий колір мають пари йоду, синій — рідкий кисень, сірий — графіт і силіцій. Безбарвним є алмаз, забарвлення не мають також інертні гази, азот і водень.
 |  |
Червоний фосфор | Білий фосфор |
 |  |
Бром | Хлор |
 |  |
Йод | Алмаз |
Коментарі
Дописати коментар