18.12.2023.
97 трактористів. Хімія. Урок №25
Тема уроку. Алотропія. Алотропні модифікації
Домашня робота;
Уробочий зошит законспектувати тему . Розгляньте порівняльні характеристики
Зворотній зв'язок з викладачем:
1. Електронна адреса:damaskina.toma@ukr.net;
2. VIBER (0951827836) Надсилати роботи
Відповісти на запитання(усно)
1) У чому полягають відмінності між алотропними модифікаціями Оксигену? Карбону?
2) Як пояснити різку відмінність фізичних і хімічних властивостей алотропних модифікацій Оксигену? Карбону?
3) Яке значення має озоновий шар Землі для живих організмів?
4) Чим відрізняються алотропні модифікації й аморфні речовини, утворені тим самим хімічним елементом?
5) Одержання штучних алмазів із графіту — це явище фізичне чи хімічне? Чому?
Явище
алотропії
• Алотропія (від грецьк. allos — інший, tropos — властивість) — явище утворення хімічним елементом двох або більше простих речовин, різних за властивостями та будовою. Прості речовини одного елемента називають алотропними модифікаціями.
Алотропні модифікації властиві Оксигену, Сульфуру, Карбону та Фосфору. Ознайомимося докладніше з простими речовинами кожного з цих елементів.
Алотропні модифікації Оксигену. Оксиген утворює дві прості речовини: кисень та озон. Порівняємо їхній склад і властивості (табл. 5).
Таблиця 5
Порівняльна характеристика кисню й озону

ості
речовини, утворені тим самим елементом, називаються алотропними видозмінами
цього елемента.
Алотропія
спостерігається в багатьох елементів. Вона пояснюється наявністю двох і більше
молекул, що містять різну кількість атомів (S2, S8), або наявністю двох і
більше кристалічних форм, що характеризуються різним розташуванням атомів у
кристалічних ґратках.
1)
Алотропія Оксигену
Кисень
— безбарвний газ, без запаху. молекула — O2. Будова:
Парамагнітний
(притягується магнітом, має два неспарені електрони). Алотропна модифікація —
озон O3:
Озон
відрізняється від кисню кількістю атомів у молекулі й різко відрізняється від
кисню за фізичними й хімічними властивостями.
Озон
— це газ синього кольору з різким дратівним запахом. Назва походить від
грецького слова озейн — «запах». Токсичний, tкип = -111,9 °С (для
порівняння: у кисню tкип = -183,0 °С), інтенсивне забарвлення і краща, ніж у
кисню, розчинність.
У
природі озон утворюється з кисню під час грозових розрядів, а на висоті 10-30
км — під дією ультрафіолетового випромінювання. Він затримує шкідливе для
людини ультрафіолетове випромінювання Сонця, поглинає інфрачервоні промені
Землі, перешкоджаючи її остиганню.
Відома ще одна модифікація---O4 (н. у.) — близько 0,1 % у рідкому й до 0,05 % у твердому кисні. Рідкий і твердий кисень, на відміну від газоподібного, забарвлений у синій колір.
2) Алотропія Сульфуру
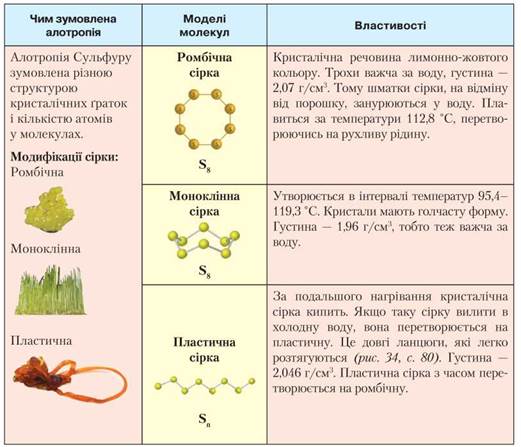
Природна
сірка — порошок жовтого кольору. Сульфур має кілька алотропних модифікацій, які
відрізняються будовою кристалічних ґраток. ромбічна й моноклінна сірка
складаються з восьмиатомних кільцеподібних молекул S8. Відмінності у властивостях
пояснюються не кількістю атомів, а різною структурою кристалів. ромбічна сірка
— жовта, моноклінна — блідо-жовтого кольору. Шари циклічних молекул пов’язані
між собою.
Третя
модифікація — пластична сірка. Вона складається із зиґзаґоподібних ланцюжків Sn, де n — до кількох тисяч.
Розрізняють
також модифікації Сульфуру — S2 (пурпурна) і S6 (оранжево-жовта).
Як
правило, з усіх алотропних видозмін хімічного елемента за певних умов стійкою є
лише одна.
Для
Сульфуру за нормального тиску й t° < 95,6 °С стійкою є ромбічна
модифікація. За кімнатної температури на неї перетворюються решта форм. У
процесі кристалізації з розплаву сірки спочатку утворюються голчасті кристали
моноклінної сірки, які за температури нижче 95,6 °С переходять у ромбічні.
За
температури вище 95,6 °С стійкою є моноклінна сірка, за температури плавлення
сірка — рухлива жовта рідина. У результаті подальшого нагрівання вона буріє,
втрачаючи рухливість. Якщо вилити її в холодну воду (швидке охолодження),
утвориться еластична, схожа на гуму коричнева маса — пластична сірка.
3) Алотропія Фосфору
Порівняльна характеристика алотропних модифікацій Фосфору

Продовження табл. 7

Продовжимо
вивчення явища алотропії на прикладі сполук Фосфору.
У
вільному стані існує кілька алотропних видозмін. У парі — це молекули
правильної тетраедричної форми P4. Унаслідок охолодження пара
переходить у білу форму, утворену молекулами Р4 (ρ = 1,8 г/см3, Тпл = 44 °С). У
воді білий фосфор не розчиняється. Зберігають його під шаром води в темряві,
тому що він леткий. Кристалічна ґратка — молекулярна. Надзвичайно отруйний!
Розчиняється в багатьох органічних розчинниках. У разі зберігання на світлі, за
незначного нагрівання без доступу повітря переходить у порошок червоного
кольору:
Процес прискорюється в результаті нагрівання під дією світла, у присутності слідів іоду.
Є червоний фосфор.Практично
червоний фосфор одержують шляхом тривалого нагрівання білого фосфору до
температури 280-340 °С. Це порошок, ρ = 2,3 г/см3, не розчинний у воді. Не
леткий, не отруйний. Використовується в сірниковому виробництві:
6P (коробок) + 5КСlО3 — 3Р2О5 + 5KCl
Запалюється
під час горіння. Пара червоного фосфору, конденсуючись, перетворюється на білий
фосфор.
Білий
фосфор активніший за червоний: окислюється навіть за низьких температур і
запалюється за температури 50 °С, червоний майже не окислюється. Інші реакції з
білим фосфором також протікають більш енергійно.
Витримуванням
білого фосфору за температури 220 °С і тиску 12 тис. атм можна одержати чорний
фосфор (ρ = 2,7 г/см3). Чорний фосфор має шарувату структуру й за зовнішнім
виглядом схожий на графіт, напівпровідник, а за хімічними властивостями
подібний до червоного фосфору. Під тиском 18 тис. атм плавиться за температури
близько 400 °С, а під тиском своєї пари переходить у фіолетовий. За тиску понад
111 тис. атм — металева фаза фосфору.
4) Алотропні модифікації Карбону

Карбон
утворює дві найбільш відомі модифікації — алмаз і графіт. Відомий також карбін.
Аморфний вуглець — деревне вугілля, сажа.
Характеристика
основних алотропних модифікацій Карбону
Алмаз.
ρ = 3,5 г/см3, найтвердіший з усіх мінералів. Чисті алмази — безбарвні та
прозорі. (Розглядаємо модель кристалічної ґратки алмаза.)
Утворення
природних алмазів відбувалося шляхом кристалізації С у глибинних шарах Землі
(200-300 км від поверхні), t° = 3 000 °С, Р = 200 тис. атм. їх
родовища пов’язані з рідкісними виходами на поверхню особливої гірської породи
— кімберліту. Промислові розробки містять близько 0,5 г алмаза на 1 т породи
(Якутія, Південна Африка).
Кожен
атом Карбону в алмазі з’єднаний з чотирма іншими ковалентним неполярним
зв’язком, причому відстані від його центра до центра інших атомів однакові
(1,54 А). Відносно кожного атома Карбону чотири сусідні перебувають у кутах
правильного тетраедра. Ґратка алмаза — атомна (демонстрація кристалічної
ґратки). Чотири однакові електронні хмари спрямовані до вершин тетраедра.
Алмаз
крихкий і розколюється від удару. Проводить тепло, але не проводить
електричного струму.
Не
діють на алмаз кислоти й луги. На повітрі горить за температури 900 °С, а за t° ≥ 1 200 °С за відсутності
повітря графітується.
Графіт.
Сіра, жирна на дотик, з металевим блиском маса, ρ = 2,2 г/см3, м’який, легко
дряпається нігтем і після тертя ним об папір залишає сірі смуги.
Кристал
графіту побудований із плоских сіток атомів Карбону, що розташовуються один над
одним. (Розглядаємо модель кристалічної ґратки графіту.)
Кожен
атом Карбону з’єднаний трьома ковалентними зв’язками з трьома іншими атомами
(1,42 А — міцний зв’язок). Відстань між шарами — 3,35 А (зв’язок слабший), тому
розщеплюється на лусочки в разі механічного впливу (tпл = 4 492 °С за Р = 10 атм).
Четвертий
валентний електрон утворює слабкі металеві зв’язки між шарами.
Добре
проводить тепло, має близьку до металів електропровідність.
Перехід
«алмаз
Аморфні
модифікації Карбону
Деревне
вугілля утворюється в результаті нагрівання деревини без доступу повітря.
Рихлий чорний продукт, зберігає структуру деревини.
Тваринне
вугілля утворюється в результаті обвуглювання тваринних тканин.
Сажа
— продукт неповного згоряння органічних сполук.
Використайте матеріал
для підготовки до уроку:
Значення озонового шару Землі. Вплив людини на
озоновий шар
Озонова
діра, всупереч своїй назві, — це не пролом в атмосфері. В атмосфері озон
сконцентрований у так званому озоновому шарі, розташованому на висоті близько
30 км у межах стратосфери. У цьому шарі відбувається поглинання
ультрафіолетового випромінювання Сонця, інакше сонячна радіація могла б завдати
великої шкоди життю на поверхні Землі. Будь-яка загроза озоновому шару
заслуговує на серйозне ставлення. У 1985 році британські вчені, які працювали
на Південному полюсі, виявили, що під час антарктичної весни рівень озону в
атмосфері там значно нижчий за норму. Щорічно в той самий час кількість озону
зменшувалася — іноді більшою мірою, іноді меншою. Подібні, але не настільки
яскраво виражені, озонові діри з’являлися також над Північним полюсом — під час
арктичної весни.
Упродовж
наступних років учені з’ясували, чому з’являється озонова діра. Коли сонце
ховається й починається довга полярна ніч, відбувається різкий спад температури
й утворюються високі стратосферні хмари, що містять кристалики льоду. Поява цих
кристаликів спричиняє серію складних хімічних реакцій, які приводять до
накопичення молекулярного хлору (молекула хлору складається з двох з’єднаних
атомів Хлору). Коли з’являється сонце й починається антарктична весна, під дією
ультрафіолетових променів відбувається розрив внутрішньо-молекулярних зв’язків
і в атмосферу спрямовується потік атомів Хлору. Ці атоми виступають у ролі
каталізаторів реакцій перетворення озону на простий кисень, що протікають за
такою подвійною схемою:
Cl + О3
СlО + О
У
результаті цих реакцій молекули озону (О3) перетворюються на молекули кисню
(О2), причому вихідні атоми Хлору залишаються у вільному стані та знову беруть участь
у цьому процесі (кожна молекула Хлору руйнує мільйон молекул озону до того, як
вони вийдуть з атмосфери під дією інших хімічних реакцій). Унаслідок цього
ланцюжка перетворень озон починає зникати з атмосфери над Антарктидою,
утворюючи озонову діру. Однак незабаром, після потепління, антарктичні вихрі
руйнуються, свіже повітря (що містить новий озон) спрямовується в цей район, і
діра зникає.
У
1987 році в Монреалі відбулася Міжнародна конференція, присвячена загрозі
озоновому шару, і промислово розвинені країни домовилися про скорочення та,
врешті-решт, про припинення виробництва хлорованих і флуорованих вуглеводнів
(хлорфлуор-карбонів, ХФК) — хімічних речовин, що руйнують озоновий шар.
Сьогодні вчені вважають, що приблизно через п’ятдесят років озоновий шар
відновиться остаточно.
Коментарі
Дописати коментар